Athersys est une entreprise de biotechnologie en phase avancée de développement de son produit de cellules souches MultiStem pour de multiples indications de soins intensifs. Actuellement, elle dispose de deux programmes en phase avancée de développement, l’accident ischémique cérébral et le syndrome de détresse respiratoire aiguë (SDRA). Leur partenaire au Japon, Healios, évalue également MultiStem pour les mêmes deux indications. En outre, ils ont plusieurs programmes en phase intermédiaire et préclinique actuellement en cours de développement. Leur produit, MultiStem, est une thérapie cellulaire allogénique « prête à l’emploi » dérivée de la moelle osseuse d’adultes consentants et en bonne santé. MultiStem est très évolutif et peut produire de grandes quantités de doses à partir d’une seule banque de donneurs. Dans cet article, j’aborderai les principaux catalyseurs potentiels à venir et les opportunités pour Athersys et son partenaire Healios, ainsi que la proposition de valeur pour les investisseurs.
Programme ARDS
Le premier programme que j’aborderai est le programme ARDS. En 2016, Athersys a lancé une étude exploratoire de phase 1/2a (MUST-ARDS) afin d’évaluer son produit candidat MultiStem chez des patients souffrant de SDRA modérés à sévères, en vue d’un éventuel bénéfice clinique. Cette étude a terminé le recrutement en 2018, et des résultats prometteurs ont été annoncés en janvier 2019 ici. Les mesures de résultats primaires axées sur la sécurité, tirées de clinicaltrials.gov, étaient la fréquence d’hypoxémie ou d’hypotension soutenue dans les 4 heures et les effets indésirables graves inattendus présumés (SUSAR) dans les 24 heures.
Cette diapositive de la dernière présentation de la société Athersys aborde clairement les principaux paramètres :
Source : Présentation de la société Athersys avril 2020 ici
Bien que cette importante étude n’ait pas été optimisée pour les résultats d’efficacité, elle a révélé plusieurs tendances positives clés, notamment un plus grand nombre de jours sans ventilateur, un plus grand nombre de jours sans soins intensifs et un taux de mortalité plus faible chez les patients recevant MultiStem que chez ceux recevant un placebo. Le programme ARDS d’Athersys a ensuite reçu la désignation Fast Track de la FDA et a été ajouté comme présentation de dernière minute à la conférence internationale de l’American Thoracic Society en mai 2019. Il est important de noter que le programme ARDS d’Athersys est le seul programme actuel à avoir reçu la désignation Fast Track de la FDA. Un clip vidéo du chercheur principal de l’étude MUST-ARDS, le Dr Geoff Bellingan, peut être visionné ici, alors qu’il parle de la thérapie cellulaire multisystémique pour le SDRA lors de la conférence.
En 2018, Athersys a également élargi une collaboration existante avec son partenaire japonais Healios, en ajoutant l’indication ARDS à l’accord initial conclu ici à partir de 2016, qui incluait l’accident ischémique cérébral. Le partenariat donne à Healios les droits de commercialisation au Japon pour certaines indications en échange d’un potentiel de développement global, de dépôts réglementaires et de paiements d’étapes de commercialisation, ainsi que de redevances sur les ventes à Athersys. Je m’étendrai sur ces paiements en tant que catalyseurs financiers potentiels à court et moyen terme plus loin dans l’article.
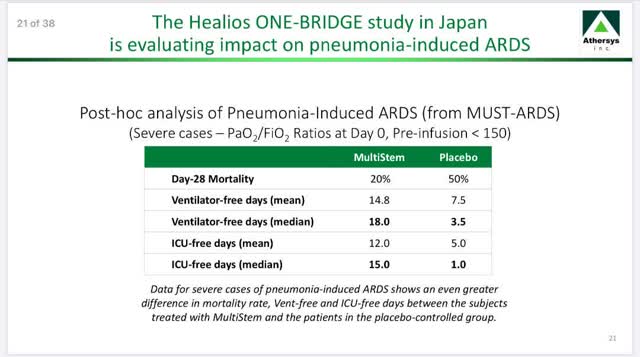
Après l’élargissement de la collaboration, Healios a ensuite lancé un essai ouvert de phase 2 sur le SDRA (ONE-BRIDGE) au Japon pour évaluer MultiStem chez des patients ayant développé un SDRA induit par une pneumonie, l’une des causes les plus fréquentes du SDRA. Le principal critère d’évaluation de l’essai est le nombre de jours sans ventilateur au cours des 28 premiers jours après l’administration de MultiStem. En outre, Healios a obtenu la désignation de médicament orphelin régénérateur au Japon pour ce programme ici, ce qui lui permettra de recevoir un examen prioritaire lors de la soumission d’une demande de commercialisation. L’analyse post-hoc de l’essai exploratoire de phase 1/2a d’Athersys a montré des résultats prometteurs dans cette sous-population de patients atteints de SDRA, comme le montre cette diapositive de la présentation de la société Athersys d’avril 2020.
Source : Présentation de la société Athersys avril 2020 ici
Le SDRA prend une toute nouvelle importance en ce moment où le monde lutte pour contrôler la pandémie de coronavirus (COVID-19). L’une des principales causes de décès dues au coronavirus est les complications du SDRA provoqué par la pneumonie. Cela place Athersys et son partenaire Healios dans une position unique et favorable pour répondre rapidement à ce besoin non satisfait. Athersys a récemment annoncé un vaste essai clinique pivot multicentrique de phase 2/3 pour traiter les patients souffrant de SDRA modéré à sévère induit par COVID-19 ici. Cette importante étude, connue sous le nom d’essai MACOVIA (MultiStem Administration for COVID-19 Induced ARDS), évaluera environ 400 patients souffrant d’un SDRA modéré à sévère induit par la nouvelle maladie à coronavirus (COVID-19) et devrait commencer à recruter des patients au cours du deuxième trimestre 2020. Le PDG d’Athersys, Gil Van Bokkelen, parle de leur programme de SDRA dans cette interview avec Fox News.
Conformément à ce formulaire 8-K déposé auprès de la SEC, Athersys est actuellement en discussion avec la Biomedical Advanced Research and Development Authority (BARDA) pour accélérer l’avancement de MultiStem afin de traiter les patients atteints de SDRA résultant de l’épidémie de COVID-19 et d’autres pandémies potentielles. Selon l’entreprise, la thérapie MultiStem a été désignée par la BARDA comme « hautement pertinente » pour le COVID-19 et d’autres agents pathogènes. Ceci est significatif dans le contexte du processus d’acquisition des contre-mesures médicales de BARDA BAA. BARDA évalue les propositions en utilisant les critères (énumérés par ordre d’importance) de la pertinence du programme, des mérites scientifiques et techniques globaux de la proposition, et des capacités de l’offrant et de l’expérience connexe, y compris les qualifications, les capacités et l’expérience du personnel clé proposé. Bien que BARDA ne publie pas ses classifications de pertinence, il va de soi qu’elle possède sa propre méthode interne de classification des thérapies potentielles, étant donné que la pertinence est le critère le plus important dans le processus d’évaluation. Si Athersys et BARDA achèvent les négociations contractuelles, un contrat pourrait alors être attribué. Celui-ci pourrait inclure le financement, l’assistance technique et les services de base, allant d’un réseau d’organismes de recherche clinique à des centres d’innovation en matière de développement et de fabrication avancés, et à un réseau de fabrication de produits de remplissage et de finition. Un contrat avec BARDA représenterait un un important catalyseur à court terme pour Athersys.
Healios a récemment annoncé l’inclusion d’une cohorte supplémentaire de patients atteints de SDRA induits par COVID-19 dans leur essai de SDRA existant ici. Il est important de noter que les résultats des cinq nouveaux cas de SDRA induits par COVID-19 pourraient être inscrits rapidement étant donné la gravité de la pandémie actuelle, et seront vérifiés séparément des 30 patients ONE-BRIDGE prévus à l’origine. Selon la société, l’ajout de cette cohorte COVID-19 n’aura aucun effet sur la progression de l’essai clinique initialement prévu. Bien que l’essai ONE-BRIDGE ait une date d’achèvement principale estimée au 31 décembre 2020 sur clinicaltrials.gov, le PDG de Healios, Hardy Kagimoto, a déclaré dans la dernière mise à jour de la société, le 20 février 2020 (à 11h25 de la vidéo), que l’essai pourrait se terminer plus tôt. De plus, le directeur de Healios, Greg Bonfiglio, a récemment révélé lors de la conférence Phacilitate Leaders World & World Stem Cell Summit 2020 que l’essai ARDS devrait se terminer en mai (le mois prochain) si le recrutement se poursuit comme prévu. La vidéo de la conférence est ici, et il fait des remarques sur Healios de 9h45 à 11h05 environ. L’annonce par Healios qu’il a terminé l’enrôlement de son essai ARDS plus tôt que prévu permettrait un autre catalyseur important à Athersys. N’oubliez pas que Healios a obtenu la désignation d’orphelin pour ce programme au Japon et qu’il sera examiné en priorité pour approbation. Si l’indication ARDS est approuvée au Japon, Athersys a droit à des étapes de dépôt et d’approbation réglementaire basées sur le succès pour l’ARDS, totalisant jusqu’à 50 millions de dollars par ce formulaire 8-K de dépôt de rapport actuel auprès de la SEC, ce qui fournirait une infusion de liquidités au bilan d’Athersys. En vertu de ce même formulaire 8-K, Athersys aura également le droit de recevoir des redevances échelonnées sur les ventes de produits agrégés, commençant dans les deux chiffres inférieurs et augmentant progressivement jusqu’à l’adolescence supérieure en fonction des niveaux de ventes nettes, ainsi que des étapes de ventes potentielles allant jusqu’à 175 millions de dollars.
Programme de lutte contre les accidents ischémiques aigus
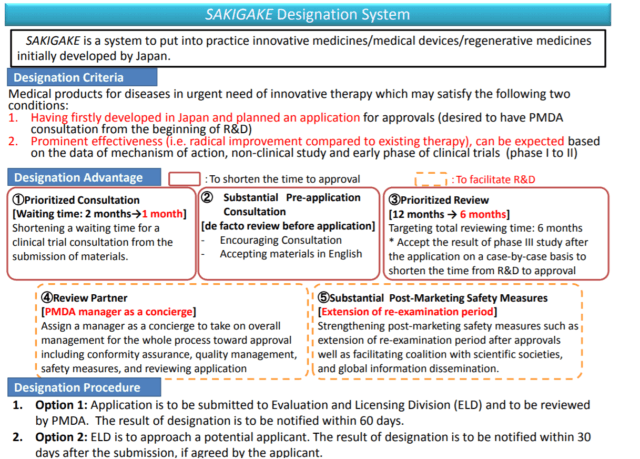
Le deuxième programme que j’aborderai est celui des accidents ischémiques aigus. Les accidents ischémiques aigus représentent un autre domaine important de besoins non satisfaits. Athersys et Healios mènent tous deux actuellement des essais d’enregistrement pour les accidents ischémiques aigus, appelés respectivement MASTERS-2 et TREASURE. Le programme de phase 3 d’Athersys est mené dans le cadre d’une évaluation spéciale du protocole (SPA) et a reçu de la FDA les désignations de thérapie avancée en médecine régénérative (RMAT) et de procédure accélérée. Ces importantes désignations ont été attribuées par la FDA après la publication des résultats de l’essai de phase 2 d’Athersys (MASTERS-1). Le programme d’AVC ischémique de Healios au Japon a reçu la désignation Sakigake au Japon, qui qualifie le programme pour une évaluation accélérée. Cette diapositive du ministère de la santé, du travail et des affaires sociales (MHLW) au Japon illustre les critères de désignation et les avantages des thérapies utilisant la désignation Sakigake. Dans les critères de désignation, le point 2 indique clairement que « l’on peut s’attendre à une efficacité importante ». L’ensemble de données de la phase 2 de MASTERS-1 a été utilisé pour faire cette détermination. Un avantage clé de la désignation est un examen prioritaire dans les 6 mois suivant la soumission.
Source : Résumé de la stratégie de Sakigake par le MHLW ici
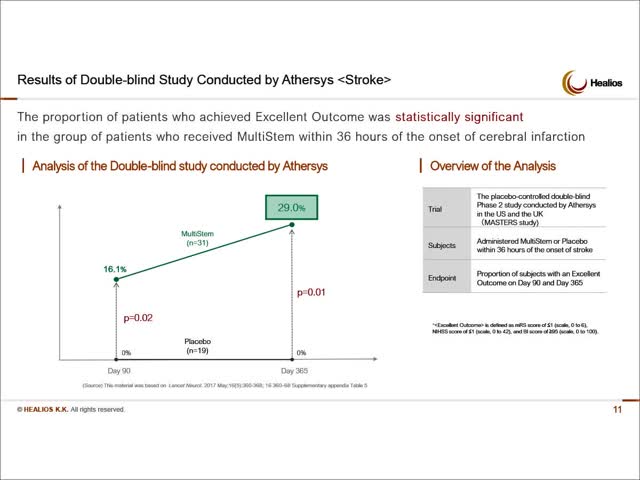
Bien que le critère d’évaluation principal de l’étude de phase 2 d’Athersys ne soit pas statistiquement significatif à 90 jours, une analyse post hoc détaillée a montré que les patients ayant reçu MultiStem dans les 36 heures ont constaté des améliorations spectaculaires par rapport aux patients n’ayant reçu qu’un placebo à la fois à 90 et à 365 jours. Là encore, toutes les désignations réglementaires ont été attribuées après la publication des résultats. Le tableau suivant, tiré de la présentation de la société Athersys d’avril 2020, illustre ces résultats :
Source : Présentation de la société Athersys avril 2020 ici
L’essai de phase 2/3 TREASURE de Healios pour l’AVC ischémique aigu a été lancé en novembre 2017. Le principal critère d’évaluation est la proportion de sujets présentant un excellent résultat défini par les évaluations fonctionnelles où le score mRS de ≤1 (échelle, 0 à 6), le score NIHSS de ≤1 (échelle, 0 à 42), et le score BI de ≥95 (échelle 0-100) au jour 90. La justification de l’essai indique ici qu' »en administrant MultiStem dans les 36 heures, on a constaté une amélioration significative de l’efficacité par rapport au placebo dans les 36 heures (l’excellent résultat était de 16,1% dans le groupe MultiStem et de 0% dans le groupe placebo, p=0,02). En outre, si le groupe utilisant à la fois le rt-PA et la thrombectomie endovasculaire était exclu, l’efficacité de MultiStem par rapport au placebo était confirmée ». Le tableau suivant, tiré de la présentation des résultats de Healios pour l’année fiscale 19, illustre bien ce point :
Source : Présentation des résultats financiers de Healios FY2019 ici
Le procès TREASURE devrait se terminer cet été, selon les récentes révélations. La plus récente révélation a été faite par Greg Bonfiglio, directeur de Healios, lors de la conférence Phacilitate Leaders World & World Stem Cell Summit 2020, où il a déclaré que l’essai TRESASURE devrait achever l’inscription d’ici septembre (voir la vidéo susmentionnée). Ceci est important pour Athersys et Healios, car les données primaires de mesure des résultats sur 90 jours seraient disponibles vers la fin de l’année 2020. Le marché cible annuel d’Healios pour les accidents ischémiques cérébraux est de 62 000 patients. S’il est approuvé au Japon, cela représente un important débouché pour Healios et un catalyseur majeur pour Athersys. Selon le rapport actuel sur le formulaire 8-K déposé auprès de la SEC, Athersys pourrait avoir droit à des paiements d’étape supplémentaires pour le développement et l’approbation réglementaire en fonction du succès, d’un montant total de 30 millions de dollars, ainsi qu’à des paiements d’étape pour les ventes potentielles d’un montant maximal de 185 millions de dollars. Pour ce même 8-K, Athersys recevrait également des redevances échelonnées sur les ventes de produits, commençant dans les chiffres les plus bas et augmentant progressivement en fonction du niveau des ventes nettes.
L’essai MASTERS-2 de phase 3 d’Athersys a débuté en juillet 2018 et continue de voir un recrutement régulier, comme l’indique la société. Cela représentera une opportunité de marché encore plus importante que le Japon et devrait se terminer avec l’inscription vers la fin de 2020. Pour une écoute détaillée de la science derrière cet important programme, je vous recommande ce podcast avec le Dr Robert « Willie » Mays, co-fondateur et vice-président de la médecine régénérative et responsable des programmes de neuroscience chez Athersys.
Autres possibilités clés du programme
Athersys a d’autres programmes clés MultiStem en cours de développement. Plus récemment, Athersys a annoncé que la FDA a autorisé le lancement d’un essai clinique de phase 2 évaluant la thérapie cellulaire MultiStem chez des patients souffrant de traumatismes. Cet essai est soutenu par le Medical Technology Enterprise Consortium (MTEC). Le MTEC est un consortium de technologie biomédicale 501c(3) collaborant dans le cadre d’un accord de transaction (OTA) avec le Commandement de la recherche et du développement médical de l’armée américaine (USAMRDC). Athersys a également obtenu la désignation Fast Track et un SPA pour son programme de lutte contre les maladies aiguës du greffon contre l’hôte, prêt pour la phase 3, ainsi que la désignation de médicament orphelin par la FDA et l’EMA. Une autre indication intrigante dans laquelle la collaboratrice d’Athersys, Emily R. Thompson, a récemment terminé une étude préclinique est la nouvelle livraison de thérapie cellulaire pour réduire les lésions de reperfusion de l’ischémie dans la transplantation de reins ici. Mme Thompson a reçu le prestigieux prix Leonardo da Vinci de la Société européenne de transplantation d’organes (ESOT) en 2019 pour ses travaux dans ce domaine en utilisant des cellules MultiStem. Athersys a également mené des travaux précliniques approfondis sur les accidents vasculaires cérébraux hémorragiques, les lésions cérébrales traumatiques, les lésions de la moelle épinière et de nombreuses autres indications, démontrant ainsi la polyvalence de la thérapie par cellules multi-souches. Nombre de ses programmes précliniques ont la capacité de passer directement à la phase 2 de développement.
Se préparer à la commercialisation
Athersys et Healios se préparent vigoureusement à la commercialisation. Récemment, Athersys a procédé à deux recrutements importants au sein de son équipe de direction. La première a été l’embauche du nouveau directeur financier Ivor Macleod, un initié expérimenté dans le domaine de la biotechnologie qui apporte une expérience précieuse acquise lors de ses passages dans des sociétés pharmaceutiques de premier plan telles qu’Eisai Inc. et Merck, entre autres. Tout aussi impressionnante est l’embauche de Maia Hansen, la nouvelle première vice-présidente des opérations et de la chaîne d’approvisionnement. Mme Hanson était auparavant associée principale chez McKinsey & Company, une société de conseil en gestion mondiale, où elle a travaillé avec des clients du monde entier pour développer et optimiser les opérations de bout en bout et les chaînes d’approvisionnement mondiales.
Healios a récemment mis en place une équipe de marketing et de vente pour « développer rapidement les activités de vente après avoir demandé et reçu l’autorisation de commercialisation », comme l’indique ce communiqué de presse. Les initiatives de fabrication se multiplient également. En 2017, Athersys a conclu un accord ici avec Nikon Cell Innovation, une filiale de Nikon Corporation, pour la fabrication de MultiStem pour Healios au Japon. Athersys a également annoncé précédemment qu’elle avait transféré avec succès sa propriété intellectuelle pour MultiStem à Nikon Cell Innovation. Le 14 avril 2020, Nikon Cell Innovation a révélé dans ce communiqué de presse qu’elle avait obtenu une licence pour la fabrication de produits de médecine régénérative. À mon avis, cela indique clairement qu’ils auront un produit à fabriquer dans les plus brefs délais.
Comme l’a indiqué Gil Van Bokkelen, président-directeur général d’Athersys, dans le cadre de l’appel de fonds du troisième trimestre de 2019, Athersys s’est engagée dans d’autres initiatives de commercialisation clés, comme l’embauche d’un organisme de recherche sous contrat (ORC) de premier plan en 2019 pour aider Athersys et Healios à préparer les informations et les documents nécessaires à l’appui des soumissions en continu et des examens prioritaires pour les deux programmes de lutte contre les accidents ischémiques cérébraux au Japon, aux États-Unis, en Europe et dans d’autres pays concernés. Athersys développe également un système de stockage cryogénique propriétaire appelé SIFU qui offrira de nombreux avantages logistiques, comme le montre cette diapositive de leur présentation d’entreprise d’avril 2020 :
Source : Présentation de la société Athersys avril 2020 ici
Situation de trésorerie
Selon ce nouveau formulaire 8-K déposé auprès de la SEC, Athersys dispose actuellement d’environ 37,5 millions de dollars de trésorerie et d’équivalents de trésorerie dans son bilan au 9 avril 2020. Cela comprend environ 7 millions de dollars de produits de l’exercice intégral par Healios de 4 millions d’actions provenant de bons de souscription existants, détaillés dans ce récent communiqué de presse. Il est important de noter que l’important exercice de bons de souscription par l’associé Healios représente une transaction d’initié majeure. Le formulaire 8-K indique également que les discussions entre Athersys et BARDA se poursuivent concernant une éventuelle collaboration, pour laquelle Athersys a a soumis sa proposition formelle. Une collaboration formelle avec BARDA, si elle est réalisée, pourrait se traduire par un financement supplémentaire pour Athersys. Enfin, au moment de la rédaction de cet article, Athersys procédait à une offre publique d’actions ordinaires qui rapportera environ 50 millions de dollars. Cette offre devrait être clôturée vers le 20 avril 2020. Je pense que la récente offre publique ne doit pas être considérée comme une indication que l’accord BARDA est hors de question, mais plutôt comme un effort pour accélérer le procès MACOVIA pendant que le processus de contrat se termine.
La proposition de valeur
Je pense qu’Athersys présente une proposition de valeur favorable pour les investisseurs potentiels. Elle a actuellement deux programmes en phase finale de développement, tous deux avec potentiel les catalyseurs à court et moyen terme qui pourrait apporter une valeur substantielle aux actionnaires. À mon avis, d’autres indicateurs positifs présentés dans cet article apportent des preuves supplémentaires que ces programmes sont considérablement réduits. Dawson James Securities assigne actuellement un objectif de prix sur un an de 12 dollars, selon leur dernier rapport d’entreprise datant du 15 avril 2020. Au moment de la rédaction de cet article, les actions d’Athersys se négociaient autour de 2,10 dollars par action. Je pense que ces actions sont extrêmement sous-évaluées à ces niveaux, étant donné les multiples opportunités de marché dans des domaines critiques où les besoins ne sont pas satisfaits, et présentent actuellement un une opportunité d’achat très convaincante pour les investisseurs potentiels.
Comme pour tout investissement, ma thèse comporte certains risques. Pour les essais cliniques du SDRA, le recrutement pourrait prendre plus de temps que prévu. Cela repousserait les échéances des catalyseurs attendus à une date ultérieure. Cependant, je pense que ces essais seront inscrits en temps voulu étant donné l’énorme besoin de thérapies pour traiter les patients atteints de SDRA induits par COVID-19. Pour les essais cliniques sur les accidents ischémiques aigus, il est possible que la pandémie de COVID-19 affecte les taux de recrutement futurs. Une récente divulgation par Athersys a cependant indiqué que la pandémie n’a pas eu d’effet négatif significatif sur leur activité. Enfin, BARDA pourrait, d’une manière ou d’une autre, choisir de ne pas initier une alliance avec Athersys. Je pense que ce scénario est très peu probable étant donné la pertinence du programme ARDS d’Athersys en ce qui concerne la pandémie COVID-19.
Divulgation : Je suis/nous sommes long(e)s ATHX. J’ai écrit cet article moi-même, et il exprime mes propres opinions. Je ne reçois aucune compensation pour cela (autre que celle de Seeking Alpha). Je n’ai aucune relation d’affaires avec une entreprise dont les actions sont mentionnées dans cet article.